BIOVIA Structured Document Authoring
文書オーサリングの変革
CMC 規制要件を理解する
CMC (化学(C)、製造(M)、管理(C))の規制文書は、FDA や EMA などの規制機関に医薬品を申請するうえで不可欠です。これらの文書は、製品の製造工程、品質管理、安定性に関する詳細な情報を提供し、安全性と有効性を保証するものです。構造化文書オーサリングにより、CMC 規制文書の作成と管理の合理化、エラーの減少、コンプライアンスの確保、市場投入までの時間の短縮を達成することができます。
CMC 提出書類の課題に対処
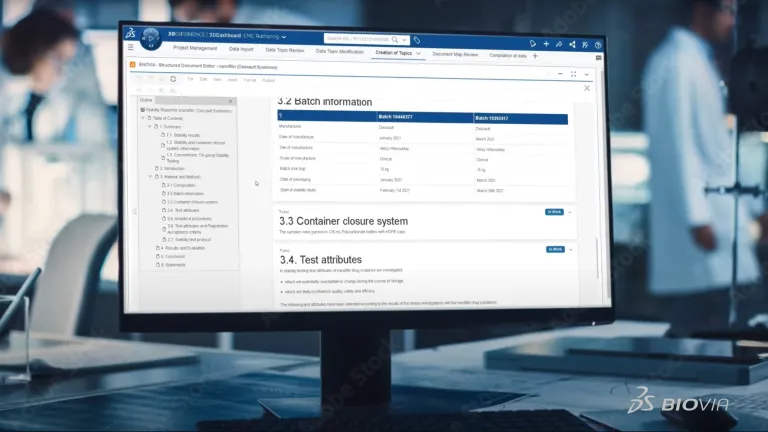
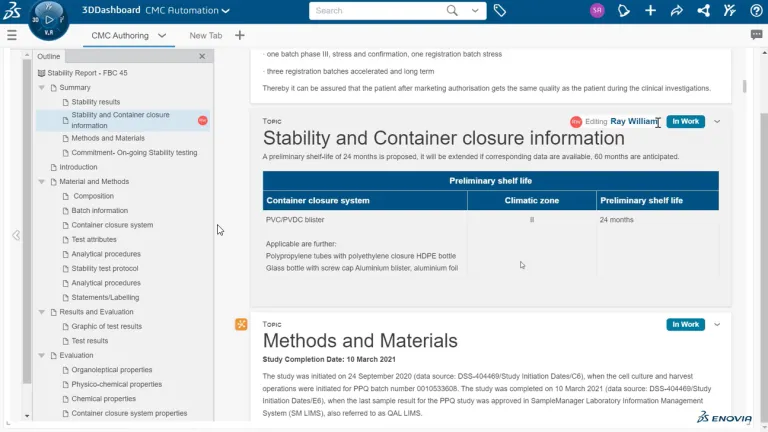
科学文書や品質文書の作成は、複雑で手間がかかり、時間もかかります。 手作業でデータを入力すると、その確認が必要になります。CMC 書類のように数百ページに及ぶ文書を作成するためには、組織全体の複数の専門担当者が協力しながら、大量のデータをまとめる必要があります。 また、文書は 1 回作成すれば、それで済むわけではありません。継続的なプロセスです。 中には、製品開発に 10 年から 15 年かけて作成され、いまだに更新され続けているものもあります。
今もなお、コピー & ペーストで CMC 書類を作成し、データ・ポイントを 1 つずつ確認しているとしたら、そのようなプロセスではエラーが発生しやすく、一貫性が失われ、あとで追跡することができなくなり、IP が危険にさらされる可能性があります。BIOVIA の構造化文書オーサリングは、それとは異なる、まったく新しい文書作成方法です。 固定的な文書からデータ中心に移行します。 手作業によるデータの検索と入力が自動化されます。 これにより、データの再検証も不要になります。
Structured Document Authoring の機能
- 文書の作成と共有
- 文書の内容、形式、レイアウトの標準化
- 文書の内容の自動更新
- 安全かつ統制されたコラボレーション
- 更新され使用されたコンテンツを監視
Structured Document Authoring の主なメリット
- 書類の作成時間を 80% 短縮
- 書類ごとのコストを 200 万ドル以上削減
- 最新のデータで正確なレポートを作成
- データの再検証にかかる手間が減り、時間を 30 ~ 70% 節約
- 透明性とトレーサビリティーを最大化
- 知的財産を保護
- 市場投入までの時間を短縮
さあ、始めましょう
構造化文書オーサリングの世界は変化しています。BIOVIA で一歩先を行く方法を発見しましょう
化学薬品の製造と管理に関する FAQ
医薬品の CMC 規制文書とは、医薬品の品質と一貫性を確保するために規制機関が要求する化学、製造、および管理に関する情報を指します。これらの文書には、製品の製造工程、品質保証と管理、および安定性に関する詳細なデータを記載します。
FDA と医薬品における CMC とは、Chemistry (化学)、Manufacturing (製造)、Controls (管理)の略で、医薬品が一貫して製造され、品質基準を満たしていることを保証するために必要な詳細な文書が含まれます。その内容としては、医薬品の組成、製造工程、および品質管理に関する情報が含まれます。
CMC の要件は、FDA のような規制機関と製薬業界でほぼ同じですが、課題はさまざまです。FDA では、厳しい米国規制基準を満たすことに重点が置かれることが多く、また、製薬業務がより広範囲に及ぶ場合、企業はグローバルな規制の調和、地域固有のガイドラインへの対応、製造における新しい技術への適応など、さらなる課題に直面します。
医薬品開発における CMC には、医薬品の組成、製造工程、および生産および保管中の製品の一貫性と安定性を維持するための統制の詳細が含まれます。医薬品承認のための規制当局への申請において、CMC の実務は重要な役割を果たします。
規制当局への申請における CMC の役割は、医薬品が一貫した品質で製造され、規制基準に準拠することを保証するために必要なデータを提供することです。これは、FDA や EMA などの保健当局との医薬品承認およびコンプライアンス・プログラムに不可欠です。
BIOVIA Structured Document Authoring は、データ入力の自動化、一貫性の確保、トレーサビリティーの向上により、CMC 文書の作成と管理を合理化します。手作業によるミスを減らし、規制に関する戦略の策定にかかる時間を短縮します。
CMC の規制当局への申請には通常、製造工程の詳細、品質管理方法、製品仕様、安定性データが含まれます。これらの構成要素は、規制当局が要求する安全性および有効性の基準を製品が満たしていることを保証します。
複雑な文書の作成と更新を自動化し、正確性と一貫性を確保するうえで、構造化文書オーサリングは CMC 規制準拠プログラムに不可欠です。これにより、ミスが減り、トレーサビリティーが向上し、規制の期限を効率的に順守することができます。
その他の情報
BIOVIA の活用方法
組織の規模の大小を問わず、シームレスなコラボレーションと持続可能なイノベーションに、このソリューションがどう役立つかについて、BIOVIA の担当技術者がご説明します。
始めましょう
学生、教育機関、専門家、企業向けのコースとクラスをご用意しています。お客様に最適な BIOVIA トレーニングを受講してください。
サポートを受ける
ソフトウェアやハードウェアの資格認定、ソフトウェアのダウンロード、ユーザー・マニュアル、サポート連絡先、サービス・オファリングに関する情報を入手できます。