QUMAS EDMS
클라우드 기반 전자 문서 관리
문서 관리에 대한 데이터 중심 접근 방식
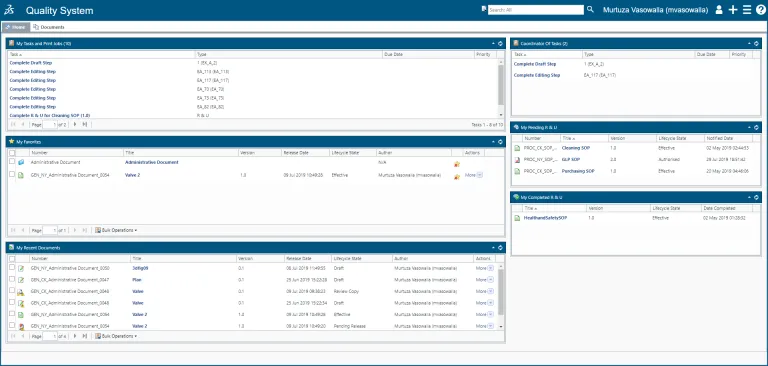
문서 및 기록된 데이터는 품질 및 규정 준수의 핵심입니다. 그러나 정적 문서를 활용하는 조직에서는 품질 데이터를 완전히 활용하지 못하고 품질 문서를 변화하는 규제 요구에 민첩하게 적용하지 못할 수 있습니다. BIOVIA QUMAS EDMS를 사용하면 기존 문서 관리에서 지능형 품질 콘텐츠 관리로 전환할 수 있습니다. BIOVIA QUMAS EDMS는 클라우드 기반의 데이터 중심 전자 문서 관리 소프트웨어 솔루션이며, 비즈니스 전반에 걸쳐 데이터 및 문서 관리, SOP 관리 및 관련 교육을 위한 검증된 규정 준수 사례를 제공합니다. QUMAS EDMS는 FDA 21 CFR Part 11 규정 준수 문서 관리 시스템입니다.
BIOVIA QUMAS 문서 관리를 사용하면 조직은 글로벌 규제 요구 사항을 준수하면서 정책, 표준 작업 절차(SOP), 작업 지침, 매뉴얼, 파일 및 보고서를 역동적으로 생성하고 제어할 수 있습니다. Word 문서와 같은 콘텐츠를 사용자 인터페이스에 끌어 놓을 수 있는 기능으로 문서 생성을 간소화합니다. 이 솔루션의 고급 데이터 중심 접근 방식은 문서 생성, 검색 및 관리를 용이하게 합니다.
고객 보고서:
-
SOP 관리 비용 20~40% 절감
-
SOP 검토 시간 20~30% 단축
-
문서화 주기 시간 30% 감소
-
처음부터 올바른 제출 60% 증가
BIOVIA QUMAS EDMS 기능 둘러보기
- 엔터프라이즈 콘텐츠 관리
- 전자 문서 관리
- 학습 관리 시스템 - LMS
- 배치 데이터 관리
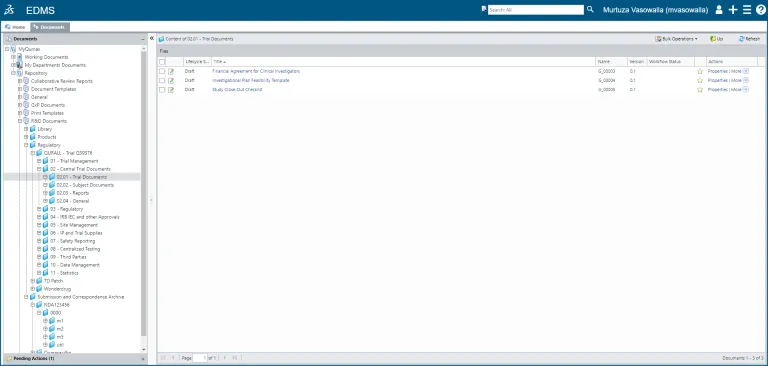
문서 생성에서부터 콘텐츠 편집, 검토/승인 및 출력물 관리, 예정된 보관 및 폐기에 이르기까지 문서(또는 문서 세트)의 전체 라이프사이클을 관리합니다.
전자 공통 기술 문서(eCTD), 비-eCTD 및 규제 제출물, 의약품 및 약물 원료 물질(CMC), 임상, 비임상 및 품질과 관련된 정책, 표준 작업 절차(SOP), 작업 지침 및 매뉴얼을 작성하고 관리합니다.
규정 준수 교육 및 관리 프로세스를 자동화하거나, 대화형 기업 규정 준수 교육을 시작, 추적 및 관리합니다(NetDimensions 기반).
다음과 같은 전용 기능으로 대량의 문서를 효율적으로 처리합니다.
- 엔터프라이즈 스캔
기존 종이 문서를 메타데이터를 포함한 전자 문서로 변환하고, 표지를 생성하거나, 조정 및 보관할 양식 배치를 인쇄하는 자동 스캔 기능 - 문서 전송 (DocTransfer)
데이터 무결성을 유지하는 메타데이터 정의를 통해 여러 신청서에서 다양한 문서의 일괄 로드 자동화, 파일 시스템에서 파일 세트 끌어 놓기 - 콘텐츠 캐시
널리 분산된 글로벌 배포 및 보다 나은 네트워크 성능을 위해 자주 사용되는 문서의 로컬 캐시 저장
SOP 관리
QUMAS EDMS는 글로벌 네트워크 전반에서 SOP의 생성, 공유, 배포 및 관리를 자동화하고 SOP 라이프사이클을 추적합니다.
- 업데이트를 쉽게 식별할 수 있도록 버전을 비교합니다.
- 현재 작업과 관련이 있는 SOP에 액세스합니다.
- 권한에 따라 콘텐츠를 검색하고, 보고, 인쇄합니다.
- 사용 중인 버전이 완벽한 규정 준수 감사 추적을 갖춘 최신의 관리된 버전인지 확인합니다.
- 21 CFR Part 11과 절차 관리를 위한 모든 cGxP 요구 사항을 준수합니다.
eCTD 및 제출 관리
약물 신청을 위한 전자 공통 기술 문서(eCTD)를 준비하는 것은 복잡하고 시간이 많이 걸리는 과정입니다. 연결되지 않은 시스템이 있는 환경에서 응답을 생성하고 승인하면 신약의 출시 시간이 지연되고 특허가 만료되기 전 수익 창출 기회가 줄어들 수 있습니다.
BIOVIA QUMAS는 다음을 하나의 통합 솔루션으로 결합합니다.
- 템플릿 기반 콘텐츠 작성 및 관리
- 규제 업무, 임상, 비임상 및 품질을 위한 실시간 협업 및 제출 관리
- FDA, EMA 또는 PMDA와 같은 규제 기관에 규정을 준수하는 방식으로 자동 전자 제출(CTD, eCTD, NeeS, IMPD, CTA, eNTA 및 VNeeS 형식 포함)
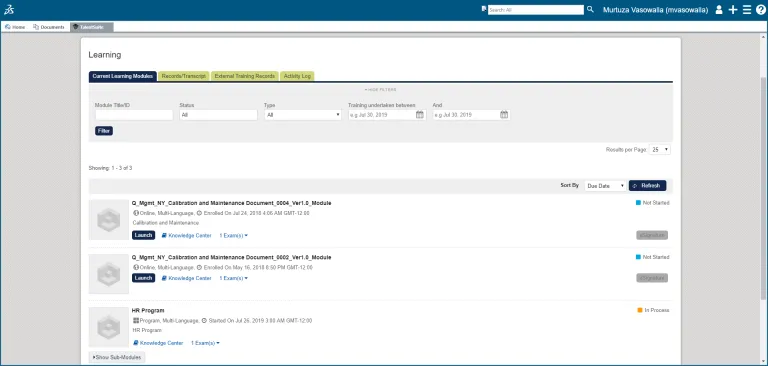
학습 관리
직원들은 관련 SOP에 대한 교육을 완료하고 자신의 이해를 확인할 수 있습니다.
각 직원은 배정된 교육 과제, 미완료 과제, 완료된 교육 과제의 전체 내역을 기록으로 보유합니다.
관리 보고 및 대시보드는 개별 직원 및 부서의 교육과 인증 상태를 명확하게 파악할 수 있으며, 이를 규제 당국에 증명할 증거와 기록을 제공합니다.
산업 프로세스 가속기 - IPA
BIOVIA QUMAS EDMS 산업 프로세스 가속기는 전용 구성, 문서(예: 검증 팩, 설계 문서, 시스템 액세스 계획), 전문 서비스(설치, 최종 사용자 및 교육자 교육) 및 최소 3개월 동안의 전문 서비스 검토가 포함됩니다. 여기에는 구성, 문서화, 검증 스크립트 및 설계 문서가 포함됩니다.
- 품질 보증 문서 IPA
- R&D 제출 문서
품질 보증 문서 IPA
품질 보증(QA) 문서의 라이프사이클 관리를 지원합니다. 구성은 QA 사용에 특화되어 있으며, 널리 수용되는 비즈니스 기본 사항을 기반으로 합니다. 여기에는 5가지 사전 정의된 GxP 문서 유형, 절차, 방법, 사양, 규정 및 일반, 콘텐츠 진행 및 관리를 위한 5가지 사전 정의된 워크플로가 포함됩니다.
R&D 제출 문서 IPA
글로벌 규제 기관에 대한 제출을 지원합니다. 구성은 R&D에 특화되어 있으며, DIA EDM 참조 모델 및 CTD 표준을 따릅니다. 여기에는 CMC(의약품, CMC), 약물 원료 물질, 사양, 임상 및 비임상 등 14가지 사전 정의된 문서 유형이 포함됩니다.
지금 바로 시작하기
생물의약품 품질의 세계가 변화하고 있습니다. BIOVIA를 통해 한발 앞서 나가는 방법을 알아보세요.
더 알아보기
BIOVIA의 지원 서비스 알아보기
다쏘시스템 솔루션은 모든 규모의 조직에서 원활한 협업과 지속 가능한 혁신을 지원합니다. 지금 BIOVIA 전문가와 상담하세요.
시작하기
학생, 교육, 전문가 및 회사를 위한 교육 과정과 강의가 제공됩니다. 귀하에게 필요한 BIOVIA 교육을 찾아보세요.
도움받기
소프트웨어 및 하드웨어 인증, 소프트웨어 다운로드, 사용자 설명서, 지원 연락처 및 서비스 제품군에 대한 정보를 확인하세요.