QUMAS EDMS
云端电子文档管理
以数据为中心的文档管理方法
文档和记录数据是确保质量与合规性的基石。然而,企业若仅使用静态文档,将无法真正利用质量数据,也无法根据不断变化的监管要求灵活调整质量文献资料。借助 BIOVIA QUMAS EDMS,您可以从传统的文档管理转向智能质量内容控制。BIOVIA QUMAS EDMS 是一款以数据为中心的云端电子文档管理软件解决方案,为整个企业的数据和文档控制、SOP 管理以及相关培训提供业经验证的合规性实践。QUMAS EDMS 是符合《联邦法规 21 章》第 11 款要求的文档管理系统。
利用 BIOVIA QUMAS 文档管理系统,企业可以动态创建和管理政策、标准操作程序 (SOP)、工作说明书、手册、文件和报告,同时符合全球监管要求;能够将 Word 文档等内容拖放到用户界面,简化文档创建。该解决方案采用以数据为中心的先进方法,便于文档的创建、搜索和管理。
客户报告:
-
SOP 管理成本降低 20-40%
-
SOP 审查时间减少 20-30%
-
文献资料周期时间缩短 30%
-
提交一次性成功的概率提高 60%
探索 BIOVIA QUMAS EDMS 的功能
- 企业内容管理
- 电子文档控制
- 学习管理系统 - LMS
- 批数据管理
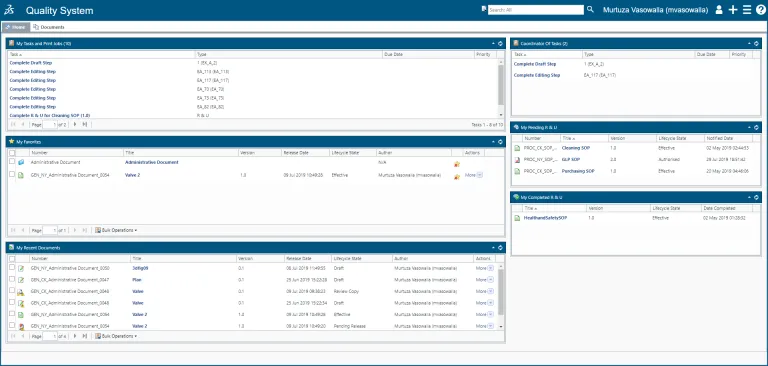
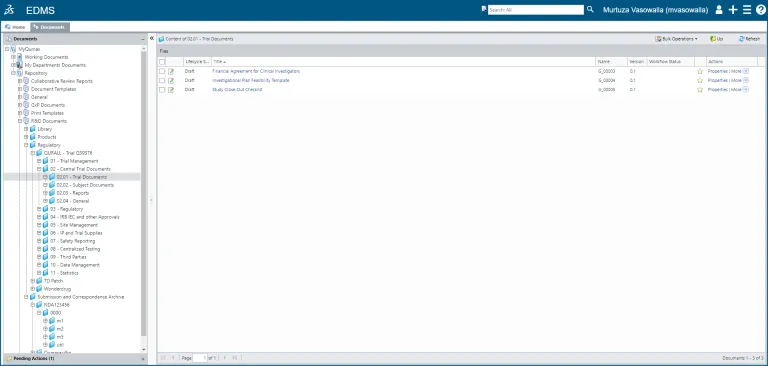
控制文档(或一批文档)的整个生命周期,从创建到内容编辑、审核/审批和硬拷贝管理,再到计划保留和报废。
为电子通用技术文档 (eCTD)、非 eCTD 和监管提交、CMC(药物产品和药物物质)、临床、非临床和质量文档创作和管理政策、标准操作程序 (SOP)、工作指令和手册。
自动实施合规性培训和管理流程,或启动、跟踪和管理交互式企业合规性培训(由 NetDimensions 提供支持)。
利用专用功能高效处理大量文档:
- 企业扫描
自动扫描,可将传统纸质档案转换为带有元数据的电子文档,创建封面页或打印要核对和存档的成批表单 - 文档传输 (DocTransfer)
通过元数据定义自动批量加载来自不同应用的多个文档,保持数据完整性;可从文件系统拖放一批文件 - 内容缓存
存储常用文档的本地缓存,适用于在全球各地广泛分散部署的情况,并可提高网络性能
SOP 管理
QUMAS EDMS 可在全球网络中自动创建、共享、分发和管理 SOP,并跟踪 SOP 的生命周期。
- 比较不同版本,轻松识别更新内容。
- 访问当前与您的工作相关的 SOP。
- 根据权限搜索、查看和打印内容。
- 确保您使用的文档版本是当前的受控版本,并具有完全合规的审计跟踪。
- 符合程序管理的所有 cGxP 要求以及《联邦法规 21 章》第 11 款要求。
eCTD 和提交管理
为药物申请准备电子通用技术文档 (eCTD) 是一个复杂且耗时的流程。在系统互不相连的环境中创建和审批响应可能会延误新药的上市进程,而且会缩短专利到期前的利润窗口期。
BIOVIA QUMAS 是集各项功能于一体的解决方案:
- 基于模板的内容创作和管理
- 法规事务、临床、非临床和质量文档的实时协作和提交管理
- 以合规的方式向 FDA、EMA 或 PMDA 等监管机构自动提交电子文件(包括 CTD、eCTD、NeeS、IMPD、CTA、eNTA 和 VNeeS 格式的文件)
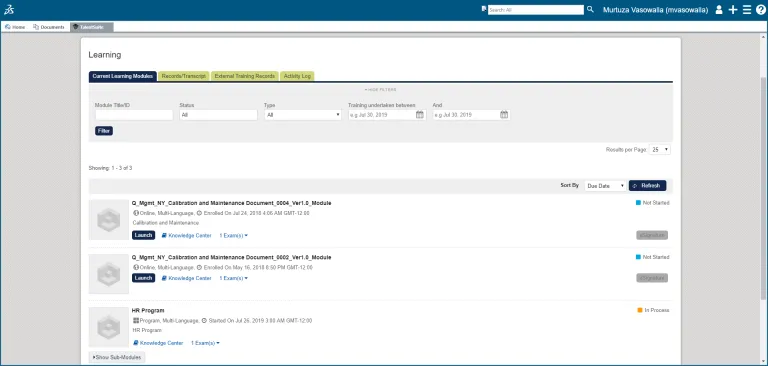
学习管理
员工可以完成相关 SOP 的培训,并确认自己理解并掌握了相关内容。
每位员工都有一份培训任务记录,上面记录了他们已分配的培训任务、未完成的培训任务,以及已完成培训任务的完整历史记录。
管理报告和看板会清晰显示个人和部门培训及认证的状态,以及可向监管机构证明该情况的证据和记录。
行业流程加速器 - IPA
BIOVIA QUMAS EDMS 行业流程加速器包括专用配置、文献资料(例如验证包、设计文档、系统访问计划)、专业服务(安装、最终用户和培训师培训),以及上线后至少 3 个月的专业服务审查。它包括配置、文献资料、验证脚本和设计文档。
- 质量保证文档 IPA
- 研发提交文档
质量保证文档 IPA
支持质量保证 (QA) 文献资料的生命周期管理。配置特定于 QA 用途,并以广泛接受的业务基本原则为基础。它们包括 5 种预定义 GxP 文档类型(程序、方法、规范、监管和通用文档),以及 5 种用于内容推进和管理的预定义工作流程。
研发提交文档 IPA
支持您向全球监管机构提交文件。配置专用于研发,并遵循 DIA EDM 参考模型和 CTD 标准。它们包括 14 种预定义文档类型,如CMC - 药物产品、CMC - 药物物质、规格、临床和非临床。
开启您的旅程
生物制药质量行业瞬息万变。了解如何利用 BIOVIA 保持领先。
了解更多
了解 BIOVIA 可以为您做些什么
与 BIOVIA 专家进行交谈,了解我们的解决方案如何在各种规模的企业中实现无缝协作和可持续创新。
了解更多内容
学生、学术界人士、专业人员和企业人员均可参加相关课程并加入班级。查找适合您的 BIOVIA 培训。
获取帮助
查找有关软硬件认证、软件下载、用户文档、支持联系人和服务项目的信息