Creación de documentos estructurados de BIOVIA
Transformación de la creación de documentos
Descripción de los requisitos normativos de CMC
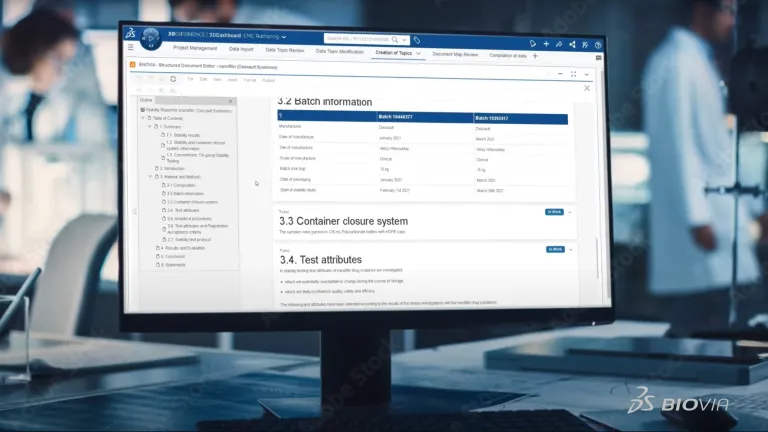
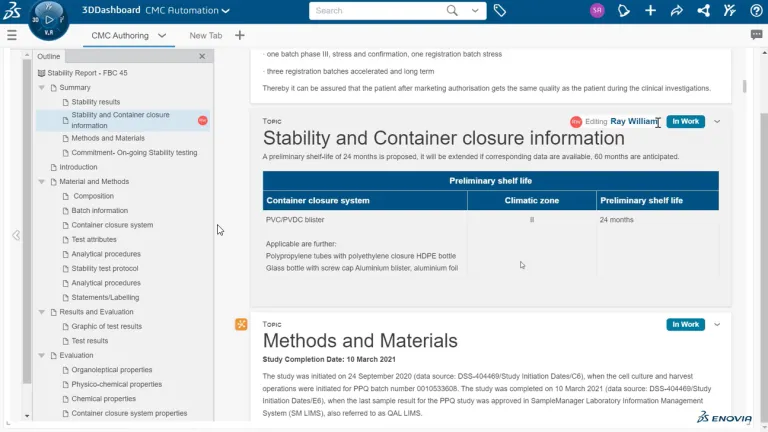
Los documentos normativos de CMC (química, fabricación y controles) son una parte fundamental de las presentaciones farmacéuticas a los organismos reguladores, como la FDA y la EMA. Estos documentos proporcionan información detallada sobre el proceso de fabricación, los controles de calidad y la estabilidad de un producto para garantizar su seguridad y eficacia. La creación estructurada de documentos agiliza la creación y gestión de documentos normativos de CMC, reduciendo los errores, garantizando el cumplimiento y acelerando el tiempo de comercialización.
Abordar los desafíos de los expedientes de CMC
La creación de documentos científicos y de calidad suele ser compleja, engorrosa y laboriosa. Las entradas de datos manuales deben volver a verificarse. Varios expertos de todas las organizaciones tienen que colaborar para recopilar grandes cantidades de datos y crear documentos de cientos de páginas, como los expedientes de CMC. Y, además, la creación de documentos no se hace una sola vez. Es un proceso continuo. Algunos de ellos se producen durante los diez a quince años de desarrollo del producto y todavía se tienen que actualizar.
¿Todavía está creando sus expedientes de CMC con la función de copiar y pegar y volviendo a verificar cada dato? En ese caso, sus procesos podrían ser propensos a errores, lo que daría lugar a incoherencias, falta de trazabilidad y poner en peligro su propiedad intelectual. La creación estructurada de documentos de BIOVIA es una forma radicalmente nueva de crear documentos. Se centra en los datos y se aleja de los documentos estáticos. Se trata de un proceso automatizado frente a la búsqueda e introducción manual de datos. Esto también hace que la reverificación de datos sea obsoleta.
Funcionalidades de la creación de documentos estructurados
- Cree y comparta documentos.
- Estandarice el contenido, el formato y el diseño de los documentos.
- Actualice automáticamente el contenido del documento.
- Colabore de forma segura y controlada.
- Supervise el contenido actualizado y utilizado.
Principales ventajas de la creación de documentos estructurados
- Reduzca el tiempo de creación de expedientes en un 80 %.
- Reduzca los costes en más de 2 millones de dólares por expediente.
- Genere informes precisos con datos actuales y actualizados.
- Ahorre entre un 30 y un 70 % de tiempo al omitir la reverificación de datos.
- Maximice la transparencia y la trazabilidad.
- Proteja su propiedad intelectual.
- Acelere el tiempo de comercialización.
Comience su viaje
El mundo de la creación de documentos estructurados está cambiando. Descubra cómo mantenerse un paso por delante con BIOVIA
Preguntas frecuentes sobre la fabricación el control en química
La documentación reglamentaria de CMC de los productos farmacéuticos se refiere a la información sobre química, fabricación y controles requerida por los organismos reguladores para garantizar la calidad y consistencia de los productos farmacéuticos. Estos documentos proporcionan datos detallados sobre los procesos de fabricación del producto, el aseguramiento y el control de calidad, así como la estabilidad.
En la FDA y el sector farmacéutico, CMC significa Química, Fabricación y Controles, que abarca la documentación detallada necesaria para garantizar que un producto farmacéutico se fabrica de forma consistente y cumple con los estándares de calidad. Esto incluye información sobre la composición del fármaco, el proceso de fabricación y los controles de calidad.
Si bien los requisitos de CMC son similares en todos los organismos reguladores como la FDA y el sector farmacéutico a nivel mundial, los desafíos pueden variar. En la FDA, el enfoque se centra a menudo en cumplir con las estrictas normas reguladoras estadounidenses, mientras que en la práctica farmacéutica más amplia, las empresas se enfrentan a retos adicionales como la armonización normativa global, el tratamiento de directrices regionales específicasy la adaptación a las nuevas tecnologías en la fabricación.
CMC en el desarrollo de fármacos incluye la información detallada sobre la composición del fármaco, los procesos de fabricación y los controles establecidos para mantener la consistencia y estabilidad del producto durante la producción y el almacenamiento. Las prácticas de CMC desempeñan un papel crucial en las presentaciones normativas para la aprobación de fármacos.
La función de CMC en las presentaciones normativas es proporcionar los datos necesarios que garanticen que un producto farmacéutico se produce con una calidad constante y se adhiere a los estándares normativos. Esto es esencial para la aprobación de fármacos y el programa de cumplimiento con las autoridades sanitarias, como la FDA y la EMA.
La creación de documentos estructurados de BIOVIA ayuda a agilizar la creación y gestión de documentos CMC mediante la automatización de la introducción de datos, garantizando la consistencia y mejorando la trazabilidad. Reduce los errores manuales y acelera el tiempo de compilación de la estrategia normativa.
Una presentación normativa de CMC normalmente incluye detalles del proceso de fabricación, métodos de control de calidad, especificaciones del producto y datos de estabilidad. Estos componentes garantizan que el producto cumpla los estándares de seguridad y eficacia exigidos por los organismos reguladores.
La creación estructurada de documentos es crucial para el programa de cumplimiento normativo de CMC porque automatiza la creación y actualización de documentos complejos, garantizando la precisión y la consistencia. Esto reduce los errores, mejora la trazabilidad y ayuda a las organizaciones a cumplir los plazos normativos de forma eficaz.
Descubra también
Descubra lo que BIOVIA puede hacer por usted
Hable con un experto de BIOVIA para descubrir cómo nuestras soluciones permiten colaborar sin problemas e innovar de manera sostenible en organizaciones de todos los tamaños.
Ponerse en marcha
Los cursos y las clases están disponibles para estudiantes, instituciones académicas, profesionales y empresas. Encuentre la formación de BIOVIA adecuada para usted.
Obtener ayuda
Encuentre información sobre certificación de software y hardware, descargas de software, documentación del usuario, contacto con soporte y oferta de servicios