BIOVIA Structured Document Authoring
Transformer la création de documents
Comprendre les exigences réglementaires en matière de CMC
Les documents réglementaires CMC (Chemistry, Manufacturing, and Controls, pour chimie, fabrication et contrôles) constituent une partie essentielle des demandes d'autorisation pharmaceutiques soumises aux organismes de réglementation tels que la FDA et l'EMA. Ces documents fournissent des informations détaillées sur le processus de fabrication, les contrôles qualité et la stabilité d'un produit afin de garantir qu'il ne présente pas de danger et qu'il est efficace. En simplifiant la rédaction et la gestion des documents réglementaires CMC, les solutions de création de documents structurés permettent de réduire les erreurs, de garantir la conformité et de réduire les délais de mise sur le marché.
Relever les défis que posent les dossiers CMC
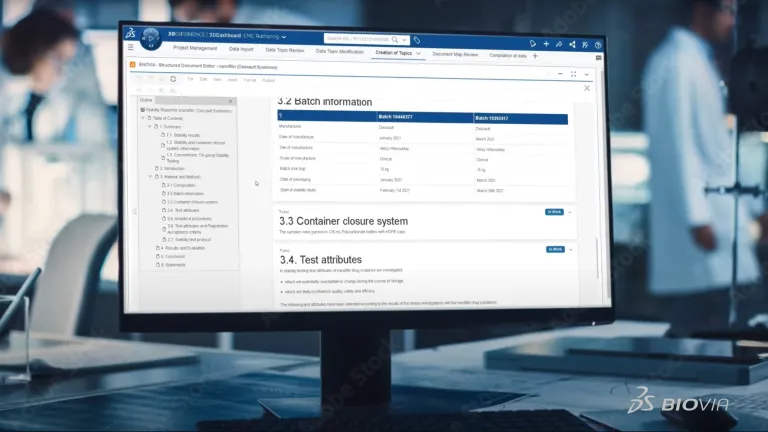
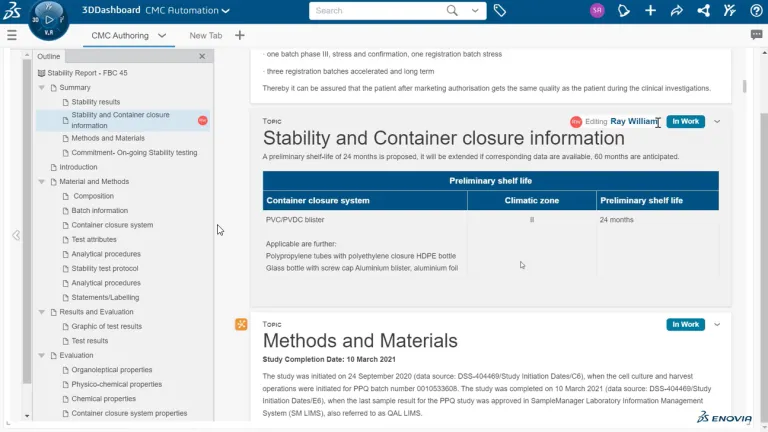
La création de documents scientifiques de qualité s'avère souvent complexe, fastidieuse et chronophage. Les saisies manuelles de données doivent être revérifiées. Plusieurs experts de l'entreprise doivent collaborer pour compiler de grandes quantités de données afin de créer des documents comprenant des centaines de pages, comme dans le cas des dossiers CMC. De plus, la création de documents n'est pas une tâche ponctuelle. Il s'agit d'un processus continu. L'élaboration de certains documents s'étale sur dix à quinze ans de développement de produit et implique une mise à jour constante.
Créez-vous toujours vos dossiers CMC par copier-coller et en revérifiant chaque point de données ? Si c'est le cas, vos processus peuvent alors être sujets aux erreurs, entraînant des incohérences, un manque de traçabilité et un danger pour la protection de votre propriété intellectuelle. BIOVIA Structured Document Authoring propose une méthode radicalement différente pour créer des documents. Cette solution est résolument centrée sur les données et abandonne les documents statiques. Elle écarte les recherches et saisies manuelles au profit d'une méthode automatisée, qui élimine également la nécessité de revérifier les données.
Fonctionnalités de Structured Document Authoring
- Créer et partager des documents
- Standardiser les contenus, les formats et les mises en page des documents
- Mettre à jour automatiquement les contenus de document
- Collaborer de manière sécurisée et contrôlée
- Surveiller les contenus mis à jour et utilisés
Avantages clés de Structured Document Authoring
- Réduire de 80 % les délais de création de dossiers
- Diminuer de plus de 2 millions de dollars les coûts par dossier
- Générer des rapports précis, avec des données actuelles et à jour
- Gagner entre 30 et 70 % de temps suite à la suppression de la phase de revérification des données
- Optimiser la transparence et la traçabilité
- Protéger la propriété intellectuelle
- Réduire les délais de mise sur le marché
Commencer votre parcours
Le monde de la création de documents structurés évolue. Découvrez comment garder une longueur d'avance avec BIOVIA.
FAQ sur les procédures CMC
Dans l'industrie pharmaceutique, la documentation réglementaire CMC fait référence aux informations de chimie, fabrication et contrôles (Chemistry, Manufacturing, and Controls) exigées par les organismes de réglementation pour garantir la qualité et la cohérence des produits pharmaceutiques. Ces documents fournissent des données détaillées sur les processus de fabrication, la stabilité, l'assurance et le contrôle qualité du produit.
Dans le contexte de la FDA et de l'industrie pharmaceutique, CMC signifie Chemistry, Manufacturing, and Controls (chimie, fabrication et contrôles). Cet acronyme englobe la documentation détaillée exigée pour garantir qu'un produit pharmaceutique est toujours fabriqué de manière uniforme et qu'il est conforme aux normes de qualité. Elle comprend des informations sur la composition, le processus de fabrication et les contrôles qualité d'un médicament.
Bien que les exigences CMC soient similaires dans tous les organismes de réglementation comme la FDA et l'industrie pharmaceutique à l'échelle mondiale, les défis rencontrés ne sont pas toujours les mêmes. Au sein de la FDA, l'accent est souvent mis sur le respect des normes réglementaires américaines les plus strictes, tandis que dans les pratiques pharmaceutiques plus larges, les entreprises sont confrontées à des défis supplémentaires tels que l'harmonisation réglementaire mondiale, le respect des directives régionales spécifiques et l'adaptation aux nouvelles technologies utilisées en fabrication.
Dans le contexte du développement de médicaments, l'approche CMC implique de détailler la composition du médicament, les processus de fabrication et les contrôles mis en place pour maintenir la constance et la stabilité du produit pendant sa production et sa conservation. Les pratiques CMC jouent un rôle crucial dans les demandes d'autorisation réglementaires de mise sur le marché de médicaments.
Le rôle des pratiques CMC dans les demandes réglementaires est de fournir les données nécessaires pour garantir la qualité constante et le respect des normes d'un produit pharmaceutique. Cette mission est fondamentale pour obtenir l'autorisation de mise sur le marché d'un médicament et respecter le programme de conformité des autorités de santé telles que la FDA et l'EMA.
BIOVIA Structured Document Authoring permet de simplifier la création et la gestion des documents CMC en automatisant la saisie des données, en assurant la cohérence et en améliorant la traçabilité. Il réduit les erreurs manuelles et facilite l'élaboration rapide d'une stratégie réglementaire.
Une demande réglementaire CMC comprend généralement le détail du processus de fabrication, les méthodes de contrôle qualité, les spécifications du produit et les données de stabilité. Ces éléments permettent de garantir que le produit répond aux normes de sécurité et d'efficacité exigées par les organismes de réglementation.
La création de documents structurés joue un rôle décisif dans le programme de conformité réglementaire CMC, car elle permet d'automatiser la rédaction et la mise à jour de documents complexes, gage de précision et de cohérence. Les conséquences sont multiples : une réduction des erreurs, une plus grande traçabilité et un respect efficace des délais réglementaires par les entreprises.
À découvrir également
Découvrir comment BIOVIA peut vous aider
Contactez un expert BIOVIA pour découvrir comment nos solutions permettent une collaboration transparente et une innovation durable dans des entreprises de toutes tailles.
Commencer
Des formations et des cours sont disponibles pour les étudiants, le monde académique, les professionnels et les entreprises. Trouvez la formation BIOVIA qui vous correspond.
Obtenir de l'aide
Obtenez des informations sur la certification des logiciels et du matériel, les téléchargements de logiciels, la documentation utilisateur, les coordonnées du support et l'offre de services.