QUMAS EDMS
Cloudbasiertes elektronisches Dokumentenmanagement
Datenzentrierter Ansatz für das Dokumentenmanagement
Dokumente und aufgezeichnete Daten sind die Eckpfeiler von Qualität und Konformität. Unternehmen, die statische Dokumente verwenden, können hochwertige Daten nicht wirklich nutzen und die Qualitätsdokumentation nicht flexibel an sich ändernde gesetzliche Anforderungen anpassen. BIOVIA QUMAS EDMS bietet Ihnen den Wechsel von der herkömmlichen Dokumentenverwaltung zur intelligenten Qualitätskontrolle von Inhalten an. BIOVIA QUMAS EDMS ist eine cloudbasierte, datenorientierte Softwarelösung zur elektronischen Dokumentenverwaltung , die bewährte Verfahren zur Konformität mit Rechtsvorschriften für die Daten- und Dokumentenkontrolle, SOP-Verwaltung und damit verbundene Schulungen im gesamten Unternehmen bietet. QUMAS EDMS ist ein mit FDA 21 CFR Part 11 konformes Dokumentenmanagementsystem.
Mit BIOVIA QUMAS Dokumentenmanagement können Organisationen Richtlinien, Standardarbeitsanweisungen (SOPs), Arbeitsanweisungen, Handbücher, Dateien und Berichte dynamisch und in Übereinstimmung mit globalen gesetzlichen Anforderungen erstellen und kontrollieren. Die Möglichkeit, Inhalte wie Word-Dokumente per Drag-and-Drop in die Benutzeroberfläche zu ziehen, vereinfacht die Erstellung von Dokumenten. Der fortschrittliche, datenorientierte Ansatz der Lösung erleichtert die Erstellung, Suche und Verwaltung von Dokumenten.
Kundenbericht:
-
20-40 % Kostenreduzierung beim SOP-Management
-
20-30 % Zeitersparnis bei der SOP-Überprüfung
-
30 % Verkürzung der Zykluszeit für die Dokumentation
-
60 % mehr fehlerfreie Erstanträge
Funktionsumfang von BIOVIA QUMAS EDMS
- Content-Management im Unternehmen
- Elektronische Dokumentenkontrolle
- Lernmanagementsystem – LMS
- Batch-Datenmanagement
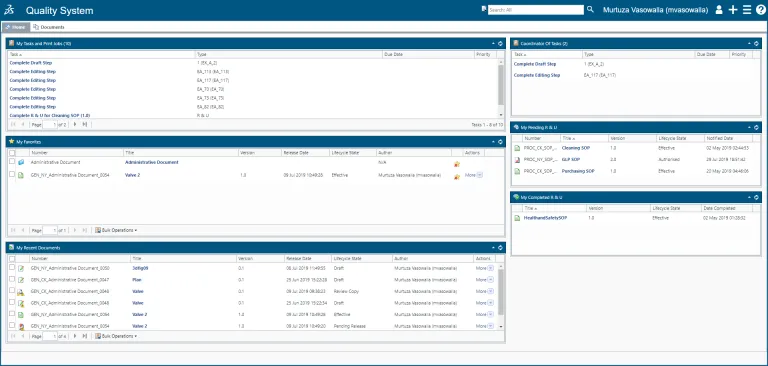
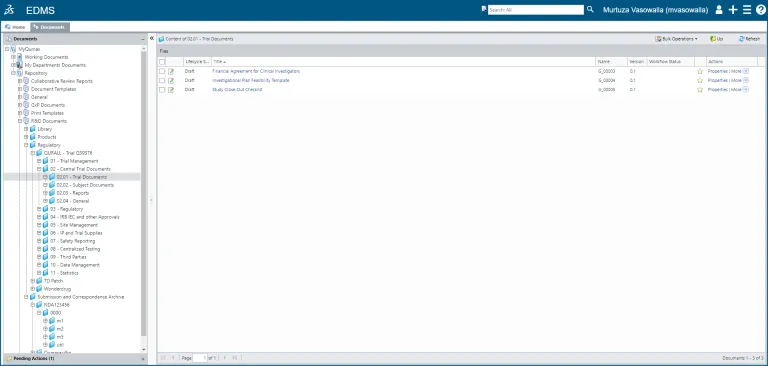
Steuern Sie den gesamten Lebenszyklus eines Dokuments (oder einer Reihe von Dokumenten), von der Erstellung über die Inhaltsbearbeitung, Prüfung, Genehmigung und Verwaltung von Papierdokumenten bis hin zur planmäßigen Aufbewahrung und Außerbetriebnahme.
Erstellen und Verwalten von Richtlinien, Standardarbeitsanweisungen (SOPs), Arbeitsanweisungen und Handbüchern – für elektronische CTD-Dokumente (eCTD), nicht-eCTD-Berichte und Zulassungsanträge, CMC-Berichte (Arzneimittelprodukt und Arzneimittelsubstanz), klinische Berichte, nicht-klinische Berichte und Qualitätssicherung.
Automatisieren Sie den Prozess für Compliance-Schulungen und -Management oder starten, verfolgen und verwalten Sie interaktive Compliance-Schulungen für Unternehmen (unterstützt von NetDimensions).
Effiziente Bearbeitung großer Mengen von Dokumenten mit speziellen Funktionen:
- Enterprise Scanning
Automatisiertes Scannen zur Konvertierung von älteren Papierarchiven in elektronische Dokumente mit Metadaten, Erstellen von Deckblättern oder Drucken von Formularstapeln, die abgeglichen und archiviert werden sollen - Document Transfer (DocTransfer)
Automatisches Laden mehrerer Dokumente aus verschiedenen Anwendungen im Batch durch Metadatendefinition zur Wahrung der Datenintegrität; Drag-and-Drop eines Dateisatzes aus dem Dateisystem - Content Cache
Speicherung eines lokalen Caches häufig verwendeter Dokumente für weit verteilte globale Bereitstellungen und für eine bessere Netzwerkleistung
SOP-Management
Mit QUMAS EDMS können Sie Erstellung, Freigabe, Verteilung und Verwaltung von SOPs in einem globalen Netzwerk automatisieren und die SOP-Lebenszyklen nachverfolgen.
- Durch einen Vergleichen der Versionen lassen sich Aktualisierungen einfach erkennen.
- Zugriff auf die SOPs, die aktuell und für Ihre Arbeit relevant sind.
- Suche nach Inhalten, Anzeigen und Ausdrucken gemäß den Berechtigungen.
- Sicherstellen, dass es sich bei der verwendeten Version um die aktuelle, kontrollierte Version des Dokuments mit einem vollständig konformen Prüfpfad handelt.
- Es müssen alle cGxP-Anforderungen für das Verfahrensmanagement sowie 21 CFR Part 11 erfüllt sein.
eCTD und Zulassungsverwaltung
Die Erstellung eines elektronischen CTD-Dokuments (electronic Common Technical Document, eCTD) für eine Arzneimittelanwendung ist ein komplexer und zeitaufwändiger Prozess. Das Erstellen und Genehmigen von Antworten in einer Umgebung mit getrennten Systemen kann die Markteinführungszeit für neue Medikamente verzögern und das Gewinnfenster vor Ablauf der Patente verkürzen.
BIOVIA QUMAS bietet dafür eine integrierte Lösung:
- Erstellung und Verwaltung von vorlagenbasierten Inhalten
- Echtzeit-Zusammenarbeit und Einreichungsmanagement für Zulassungen, klinische, nichtklinische und Qualitätssicherung
- Automatisierte elektronische Zulassungsanträge (einschließlich CTD, eCTD, Nees, IMPD, CTA, eNTA- und VNeeS-Formate) an Zulassungsbehörden wie FDA, EMA oder PMDA in konformer Weise
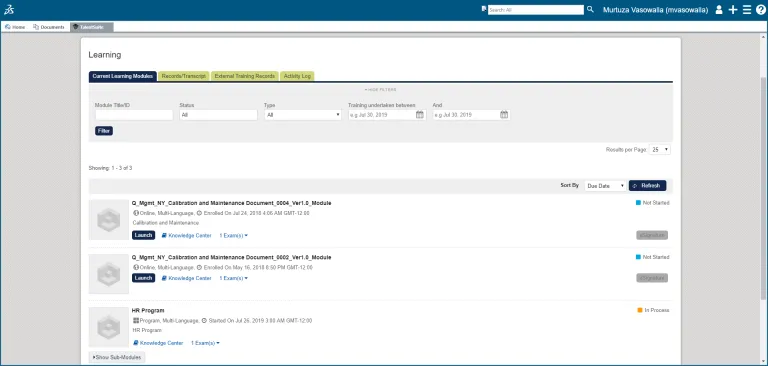
Lernmanagement
Mitarbeiter können Schulungen zu relevanten SOPs absolvieren und ihr Verständnis bestätigen.
Jeder Mitarbeiter verfügt über ein Protokoll der ihm zugewiesenen Schulungsaufgaben, der ausstehenden Aufgaben und der vollständigen Historie der abgeschlossenen Schulungsaufgaben.
Managementberichte und Dashboards bieten Ihnen einen klaren Überblick über den Status von Schulungen und Zertifizierungen von Einzelpersonen und Abteilungen, Nachweisen und Aufzeichnungen, um dies gegenüber Zulassungsbehörden zu belegen.
Industry Process Accelerators – IPAs
Die BIOVIA QUMAS EDMS Industry Process Accelerators umfassen dedizierte Konfigurationen, Dokumentation (beispielsweise ein Validierungspaket, ein Designdokument, einen Systemzugriffsplan), Professional Services (Installation, Endbenutzer- und Train-the-Trainer-Schulung) und Professional Services Reviews für mindestens 3 Monate nach dem Go-Live. Sie umfassen Konfigurations-, Dokumentations-, Validierungsskripte- und Designdokumente.
- IPA-Qualitätssicherungsdokumente
- F&E-Zulassungsdokumente
IPA-Qualitätssicherungsdokumente
Diese Dokumente unterstützen das Lebenszyklusmanagement Ihrer Qualitätssicherungsdokumentation (QS). Konfigurationen sind spezifisch für die QS-Verwendung und basieren auf allgemein anerkannten Geschäftsgrundlagen. Sie umfassen fünf vordefinierte GxP-Dokumenttypen, Verfahren, Methoden, regulatorische und allgemeine Spezifikationen und fünf vordefinierte Workflows für inhaltliche Fortschreibung und Verwaltung.
IPA F&E-Zulassungsdokumente
Unterstützt Ihre Zulassungsanträge bei globalen Zulassungsbehörden. Die Konfigurationen sind spezifisch für F&E und entsprechen dem DIA EDM-Referenzmodell und den CTD-Standards. Sie umfassen 14 vordefinierte Dokumenttypen wie CMC Arzneimittelprodukt, CMC Arzneimittelsubstanz, Spezifikationen, klinische und nicht-klinische Berichte.
Beginnen Sie Ihre Reise
Die Welt der Biopharma-Qualität ändert sich. Erfahren Sie, wie Sie mit BIOVIA immer einen Schritt voraus bleiben können.
Mehr erfahren
Erfahren Sie, was BIOVIA für Sie tun kann
Lassen Sie sich von BIOVIA Experten erklären, wie unsere Lösungen eine nahtlose Zusammenarbeit und nachhaltige Innovation in Unternehmen jeder Größe ermöglichen.
Erste Schritte
Wir bieten Kurse und Schulungen für Studierende, Hochschulen, Fachleute und Unternehmen an. Finden Sie die passende BIOVIA Schulung.
Hilfe anfordern
Informationen zu Software- und Hardware-Zertifizierungen, Software-Downloads, Anwenderdokumentation, Support-Kontakten und Serviceangeboten