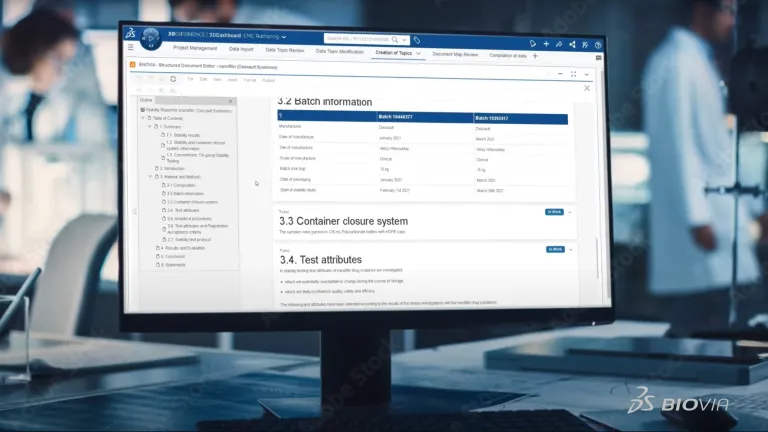
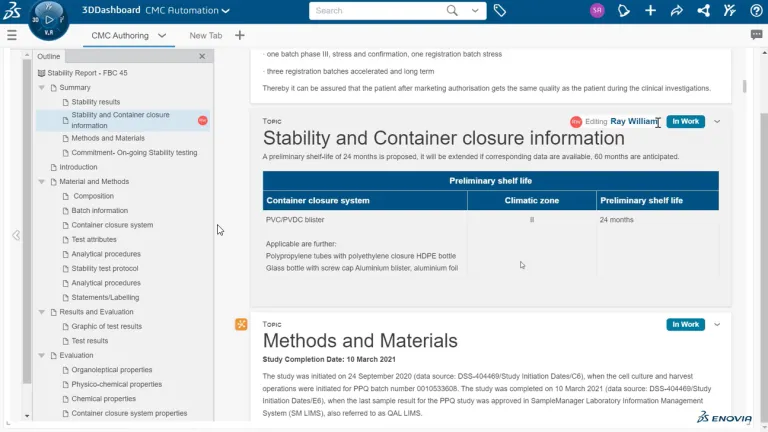
Erstellung strukturierter BIOVIA-Dokumente
Dokumenterstellung wird transformiert
Über die gesetzlichen CMC-Bestimmungen
CMC-Regulierungsdokumente für Chemie, Fertigung und Kontrollen (Chemistry, Manufacturing, and Controls, CMC) sind ein wichtiger Teil der Arzneimittelzulassungsanträge bei Zulassungsbehörden wie der FDA und der EMA. Diese Dokumente enthalten detaillierte Informationen zum Herstellungsprozess, zu Qualitätskontrollen und zur Stabilität eines Produkts, um Sicherheit und Wirksamkeit zu gewährleisten. Die strukturierte Dokumenterstellung optimiert die Erstellung und Verwaltung von CMC-Regulierungsdokumenten, reduziert Fehler, gewährleistet die Einhaltung behördlicher Anforderungen und verkürzt die Markteinführungszeit.
Bewältigung der Herausforderungen von CMC-Dossiers
Die Erstellung von wissenschaftlichen und hochwertigen Dokumenten ist oft komplex, umständlich und zeitaufwendig. Manuelle Dateneingaben müssen noch einmal verifiziert werden. Mehrere Experten in den Unternehmen müssen zusammenarbeiten , um große Datenmengen zu sammeln und Dokumente von Hunderten von Seiten zu erstellen, wie z. B. für CMC-Dossiers. Und außerdem ist die Dokumentenerstellung kein abschließender Vorgang. Es ist ein fortlaufender Prozess. Einige davon werden über zehn bis fünfzehn Jahre Produktentwicklungszeit hergestellt und immer noch aktualisiert.
Erstellen Sie Ihre CMC-Dossiers weiterhin durch Kopieren und Einfügen und die erneuter Überprüfung jedes einzelnen Datenpunkts? Dann sind Ihre Prozesse möglicherweise fehleranfällig, was zu Inkonsistenzen, mangelnder Nachverfolgbarkeit und einer Gefährdung Ihres geistigen Eigentums führen kann. BIOVIA Erstellung strukturierter Dokumente ist eine radikal neue Methode zur Erstellung von Dokumenten. Sie ist datenzentriert und verabschiedet sich von statischen Dokumenten. Sie ist automatisiert und Daten werden nicht manuell gesucht und eingegeben. Dies macht auch die Datenreverifizierung überflüssig.
Funktionsumfang von Erstellung strukturierter Dokumente
- Erstellen und Teilen von Dokumenten
- Standardisieren des Inhalts, Formats und Layouts von Dokumenten
- Dokumentinhalt automatisch aktualisieren
- Sichere und kontrollierte Zusammenarbeit
- Übersicht über aktualisierte und verwendete Inhalte erhalten
Hauptvorteile der Erstellung strukturierter Dokumente
- 80 % weniger Zeit für das Erstellen von Dossiers
- Kosten um mehr als 2 Mio. US-Dollar pro Dossier senken
- Genaue Berichte mit aktuellen Daten erstellen
- 30 – 70 % weniger Zeit ohne wiederholte Datenbestätigung
- Maximale Transparenz und Nachverfolgbarkeit erreichen
- Ihr geistiges Eigentum schützen
- Markteinführungszeit verkürzen
Beginnen Sie Ihre Reise
Die Welt der Erstellung strukturierter Dokumente verändert sich. Erfahren Sie, wie Sie mit BIOVIA immer einen Schritt voraus bleiben können
Häufig gestellte Fragen zur chemischen Fertigung und Kontrolle
Die CMC-Regulierungsdokumentation für Arzneimittel bezieht sich auf Informationen zur Chemie, Fertigung und Kontrollen, die von Zulassungsbehörden angefordert werden, um die Qualität und Konsistenz pharmazeutischer Produkte sicherzustellen. Diese Dokumente enthalten detaillierte Daten zu den Herstellungsprozessen des Produkts, der Qualitätssicherung und -kontrolle sowie der Stabilität.
In der FDA und der Pharmaindustrie steht CMC für Chemistry, Manufacturing, and Controls, was die detaillierte Dokumentation umfasst, die erforderlich ist, um sicherzustellen, dass ein pharmazeutisches Produkt konsistent hergestellt wird und die Qualitätsstandards erfüllt. Dazu gehören Informationen über die Zusammensetzung des Arzneimittels, den Herstellungsprozess und Qualitätskontrollen.
Während die CMC-Anforderungen bei Zulassungsbehörden wie der FDA und der Pharmabranche weltweit ähnlich sind, können die Herausforderungen variieren. Bei der FDA liegt der Schwerpunkt häufig auf der Einhaltung strenger US-amerikanischer regulativer Normen, während Unternehmen in der breiteren pharmazeutischen Praxis mit zusätzlichen Herausforderungen konfrontiert sind, wie z. B. der globalen Harmonisierung von Vorschriften, der Erfüllung regionalspezifischer Richtlinien und der Anpassung an neue Technologien in der Fertigung.
Die CMC in der Arzneimittelentwicklung beinhaltet die detaillierte Darstellung der Zusammensetzung des Arzneimittels, der Herstellungsprozesse und der vorhandenen Kontrollen, um die Produktkonsistenz und -Stabilität während der Produktion und Lagerung zu gewährleisten. CMC-Praktiken spielen eine entscheidende Rolle bei Zulassungsanträgen für die Zulassung von Arzneimitteln.
Die Aufgabe der CMC bei Zulassungsanträgen besteht darin, die notwendigen Daten zur Verfügung zu stellen, die sicherstellen, dass ein pharmazeutisches Produkt in gleichbleibender Qualität hergestellt wird und die regulativen Normen eingehalten werden. Dies ist für die Arzneimittelzulassung und das Konformitätsprüfungs-Programm bei Gesundheitsbehörden wie der FDA und der EMA von entscheidender Bedeutung.
BIOVIA Erstellung strukturierter Dokumente rationalisiert das Verfassen und die Verwaltung von CMC-Dokumenten durch eine Automatisierung der Dateneingabe, die Gewährleistung von Konsistenz und die Verbesserung der Nachverfolgbarkeit. Fehler durch manuelle Eingaben werden reduziert sowie die Zeit für die Ausarbeitung einer Zulassungsstrategie.
Ein CMC-Zulassungsantrag umfasst in der Regel Details zum Herstellungsprozess, Qualitätskontrollmethoden, Produktspezifikationenund Stabilitätsdaten. Diese Komponenten stellen sicher, dass das Produkt die Sicherheits- und Wirksamkeitsstandards von Zulassungsbehörden erfüllt.
Die Erstellung strukturierter Dokumente ist für das CMC-Programm zur Konformität mit Rechtsvorschriften von entscheidender Bedeutung, da es die Erstellung und Aktualisierung komplexer Dokumente automatisiert und somit Genauigkeit und Konsistenz gewährleistet. Dadurch werden Fehler reduziert, die Nachverfolgbarkeit verbessert und Unternehmen können Zulassungsfristen effizient einhalten.
Mehr erfahren
Erfahren Sie, was BIOVIA für Sie tun kann
Lassen Sie sich von BIOVIA Experten erklären, wie unsere Lösungen eine nahtlose Zusammenarbeit und nachhaltige Innovation in Unternehmen jeder Größe ermöglichen.
Erste Schritte
Wir bieten Kurse und Schulungen für Studierende, Hochschulen, Fachleute und Unternehmen an. Finden Sie die passende BIOVIA Schulung.
Hilfe anfordern
Informationen zu Software- und Hardware-Zertifizierungen, Software-Downloads, Anwenderdokumentation, Support-Kontakten und Serviceangeboten